Практическое задание 1
Тема 1. Основные понятия термодинамики. Термохимия
Задание
Рассчитать тепловой эффект химической реакции.
Величины стандартных теплот образования различных веществ 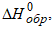 приведены в различных справочниках по химии и физической химии и в таблице 1.1. приведены в различных справочниках по химии и физической химии и в таблице 1.1.
Таблица 1.1
Стандартные энтальпии образования веществ
|
Вещество
|
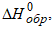 кДж/моль кДж/моль
|
Вещество
|
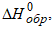 кДж/моль кДж/моль
|
Вещество
|
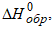 кДж/моль кДж/моль
|
|
Al2O3(корунд)
|
–1675
|
CH3CHO(г)
|
–51,0
|
Mg(OH)2
|
–924,66
|
|
Al2(SO4)3(кр)
|
–3434
|
C2H5OH(ж)
|
–277,6
|
NH3
|
–46,19
|
|
СаСО3
|
–1206
|
Cl2
|
0
|
NH4Cl(тв)
|
–315,39
|
|
CaO
|
–635,1
|
СО
|
–110.5
|
NO
|
90,37
|
|
Ca(OH)2
|
–986,2
|
CO2
|
–393,5
|
NO2
|
33,89
|
|
CH4
|
–74,85
|
COCl2(г)
|
–223,0
|
N2O4
|
9,37
|
|
C2H4
|
52,28
|
Н2
|
0
|
О2
|
0
|
|
C2H6
|
20,41
|
НС1(г)
|
–92,3
|
S(ромб)
|
0
|
|
С6H6(ж)
|
49,04
|
Н2О
|
–285,84
|
SO2
|
–296,9
|
|
C6H12(ж)
|
–179,3
|
Н2О(г)
|
–241,84
|
SO2Cl2(г)
|
–358,7
|
|
СН3ОН (ж)
|
–238,7
|
MgO
|
–601,24
|
SO3
|
–395,2
|
Таблица 1.2
Индивидуальные задания
|
№
варианта
|
Реакция
|
№
варианта
|
Реакция
|
|
А
Б
В
Г
Д
Е, Ё
Ж
З
И
К
Л
М
|
2Н2 + СО = СН3ОН (ж)
4НС1 + О2 = 2Н2О + 2С12
NH4Cl(тв) = NH3 + 3O2
2N2 + 6H2O (ж) = 4NH3+3O2
4NO+6H2O (ж) = 4NH3+5O2
2NO2 = 2NO + O2
N2O4 = 2NO2
Mg(OH)2 = MgO + H2O (г)
СаСО3 = CaO + CO2
Ca(OH)2 = CaO + H2O (г)
S(ромб) + 2H2O(ж) = SO2 + 2H2
S(ромб) + 2CO2 = SO2 +2CO
|
Н, О
П
Р
С
Т
У
Ф
Х, Ц
Ч
Ш, Щ
Э
Ю
Я
|
2SO2 + O2 = 2SO3(г)
SO2 + Cl2 =SO2Cl2(г)
CO + 3H2 = CH4 + H2O (г)
2CO + SO2 = S(ромб) +2CO2
CO + Cl2 = COCl2(г)
CO2 + H2 = CO + H2O (г)
CO2 + 4H2 = CH4 +2H2O(ж)
2CO2 = 2CO + O2
CH4 + CO2 = 2CO + 2H2
C2H6 = C2H4 +H2
C2H5OH(ж) = C2H4 + H2O(ж)
CH3CHO (г) +H2 = C2H5OH(ж)
С6H6(ж) + 3H2 = C6H12(ж)
|
Бланк выполнения задания 1
|
№ п/п
|
Задание
|
Ответ
|
|
1
|
Тепловой эффект в изобарно-изотермических условиях (ΔН0)
|
кДж/моль
|
|
2
|
Тепловой эффект в изохорно-изотермических условиях (ΔU0)
|
кДж/моль
|
Практическое задание 2
Тема 3. Химическая термодинамика
Задание
Рассчитать константу равновесия химической реакции.
Таблица 2.1
Индивидуальные задания
|
№ варианта
|
Уравнение реакции
|
|
А
|
А + 4В = 1/2С
|
|
Б
|
1/2А + 3В = С
|
|
В
|
А + 4В = 2С
|
|
Г
|
2А + 4В = ЗС
|
|
Д
|
2А + 5В = 2С
|
|
Е, Ё
|
2А + 3В = С
|
|
Ж
|
А + 6В = 2С
|
|
З
|
3А + 6В = ЗС
|
|
И
|
1/2А + 5В = 3С
|
|
К
Л
М
Н, О
П
Р
С
Т
У
Ф
Х, Ц
Ч
Ш, Щ
Э
Ю
Я
|
2А + 5В = ЗС
2A + 8B = 3C
2A + 3B = 2C
3A + 1/2B = C
3A + 1/2B = C
1/2A + 5B = 2C
3A + 3B = 3C
A + 5B = 3C
A + 2B = 1/2C
2A + 2B = C
2A + B = 1/2C
2A + 3B = C
2A + 6B = 2C
3A + 3B = C
1/2A + 4B = 1/2C
3A+ 4B = 3C
|
Бланк выполнения задания 2
|
№ п/п
|
Задание
|
Ответ
|
|
1
|
Концентрация вещества А
|
моль/м3
|
|
2
|
Концентрация вещества А
|
моль/м3
|
|
3
|
Концентрация вещества А
|
моль/м3
|
|
4
|
Константа равновесия реакции
|
(единицу измерения определить!)
|
Практическое задание 3
Тема 5. Жидкие растворы.
Задание
Найти молярную, моляльную концентрации и мольную долю вещества.
Таблица 3.1
Индивидуальные задания
|
№
|
Масс. доля
|
Вещество
|
Т, К
|
d,
|
|
варианта
|
ω2 в-ва А, вес.%
|
А
|
В
|
|
кг/м3
|
|
А
|
97
|
СВr3СНО
|
H2O
|
323
|
2628
|
|
Б
|
94
|
СВr3СНО
|
H2O
|
313
|
2566
|
|
В
|
91
|
СВr3СНО
|
H2O
|
313
|
2485
|
|
Г
|
87
|
СВr3СНО
|
H2O
|
313
|
2340
|
|
Д
|
80
|
СВr3СНО
|
H2O
|
313
|
2106
|
|
Е, Ё
|
73
|
СВr3СНО
|
H2O
|
313
|
1938
|
|
Ж
|
63
|
СВr3СНО
|
H2O
|
313
|
1725
|
|
З
|
45
|
СВr3СНО
|
H2O
|
313
|
1476
|
|
И
|
72
|
C6H5(SO3H)
|
H2O
|
298
|
1281
|
|
К
Л
М
Н, О
П
Р
С
Т
У
Ф
Х, Ц
Ч
Ш, Щ
Э
Ю
Я
|
66
61
80
62
57
50
43
37
30
23
17
12
80
60
40
20
|
C6H5(SO3H)
C6H5(SO3H)
C6H3(OH) 3
(CH2)4O2
C10H8
C10H8
C10H8
C10H8
C10H8
C10H8
C10H8
C10H8
C6H14
C6H14
C6H14
C6H14
|
H2O
H2O
H2O
H2O
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
CH3COCH3
|
298
298
293
293
293
293
293
293
293
293
293
293
293
293
293
293
|
1256
1235
1208
1041
992
968
945
921
900
875
850
835
765
741
719
692
|
Бланк выполнения задания 3
|
№ п/п
|
Задание
|
Ответ
|
|
1
|
Молярная концентрация
|
моль/л
|
|
2
|
Моляльная концентрация
|
моль/кг
|
|
3
|
Мольная доля вещества
|
|
|

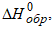 приведены в различных справочниках по химии и физической химии и в таблице 1.1.
приведены в различных справочниках по химии и физической химии и в таблице 1.1.